Μια ομάδα ερευνητών από το UC Davis Comprehensive Cancer Center εντόπισε έναν κρίσιμο επίτοπο (ένα τμήμα πρωτεΐνης που μπορεί να ενεργοποιήσει τη μεγαλύτερη πρωτεΐνη) στον υποδοχέα CD95 που μπορεί να προκαλέσει το θάνατο των κυττάρων.
Αυτή η νέα ικανότητα ενεργοποίησης προγραμματισμένου κυτταρικού θανάτου θα μπορούσε να ανοίξει την πόρτα για βελτιωμένες θεραπείες για τον καρκίνο. Τα ευρήματα δημοσιεύθηκαν πρόσφατα στο περιοδικό Cell Death &; Differentiation.
Επίσης αναφερόμενοι ως Fas, οι υποδοχείς CD95 συχνά ονομάζονται «υποδοχείς θανάτου». Αυτές οι πρωτεϊνικές δομές βρίσκονται μέσα στις κυτταρικές μεμβράνες και, κατά την ενεργοποίηση, απελευθερώνουν ένα σήμα που προκαλεί την αυτοκαταστροφή των κυττάρων.
Η ρύθμιση του Fas μπορεί επίσης να επεκτείνει τα οφέλη της θεραπείας με χιμαιρικούς υποδοχείς αντιγόνου (CAR) Τ-κυττάρων σε συμπαγείς όγκους όπως ο καρκίνος των ωοθηκών.
«Βρήκαμε τον πιο κρίσιμο επίτοπο για την κυτταροτοξική σηματοδότηση Fas, καθώς και για την αντικαρκινική λειτουργία των παρευρισκομένων CAR T-κυττάρων», δήλωσε ο Jogender Tushir-Singh, αναπληρωτής καθηγητής στο Τμήμα Ιατρικής Μικροβιολογίας και Ανοσολογίας και ανώτερος συγγραφέας της μελέτης.
«Προηγούμενες προσπάθειες για τη στόχευση αυτού του υποδοχέα ήταν ανεπιτυχείς. Αλλά τώρα που εντοπίσαμε αυτόν τον επίτοπο, θα μπορούσε να υπάρξει μια θεραπευτική πορεία προς τα εμπρός για να στοχεύσουμε τους Fas σε όγκους», δήλωσε ο Tushir-Singh.
Βρίσκοντας καλύτερες θεραπείες για τον καρκίνο
Ο καρκίνος αντιμετωπίζεται γενικά με χειρουργική επέμβαση, χημειοθεραπεία και ακτινοθεραπεία. Αυτές οι θεραπείες μπορεί να λειτουργήσουν αρχικά, αλλά σε ορισμένες περιπτώσεις, οι καρκίνοι ανθεκτικοί στη θεραπεία συχνά επιστρέφουν.
Οι ανοσοθεραπείες, όπως οι ανοσοθεραπείες που βασίζονται στα CAR T-cell και τα αντισώματα ενεργοποίησης του μορίου του υποδοχέα του ανοσοποιητικού σημείου ελέγχου, έχουν δείξει τεράστια υπόσχεση να σπάσουν αυτόν τον κύκλο.
Αλλά βοηθούν μόνο έναν εξαιρετικά μικρό αριθμό ασθενών, ειδικά σε συμπαγείς όγκους όπως ο καρκίνος των ωοθηκών, ο τριπλά αρνητικός καρκίνος του μαστού, ο πνεύμονας και το πάγκρεας.
Τα Τ κύτταρα είναι ένας τύπος ανοσοκυττάρων. Οι θεραπείες CAR T-κυττάρων περιλαμβάνουν μηχανική ασθενών Τ κυττάρων μεταμοσχεύοντάς τα με ένα συγκεκριμένο αντίσωμα στόχευσης όγκου για να επιτεθούν σε όγκους. Αυτά τα τροποποιημένα Τ κύτταρα έχουν δείξει αποτελεσματικότητα στη λευχαιμία και σε άλλους καρκίνους του αίματος, αλλά έχουν αποτύχει επανειλημμένα να παρέχουν επιτυχία έναντι συμπαγών όγκων. Ο λόγος είναι ότι τα μικροπεριβάλλοντα του όγκου είναι καλά στο να κρατούν τα Τ κύτταρα και άλλα κύτταρα του ανοσοποιητικού συστήματος στον κόλπο
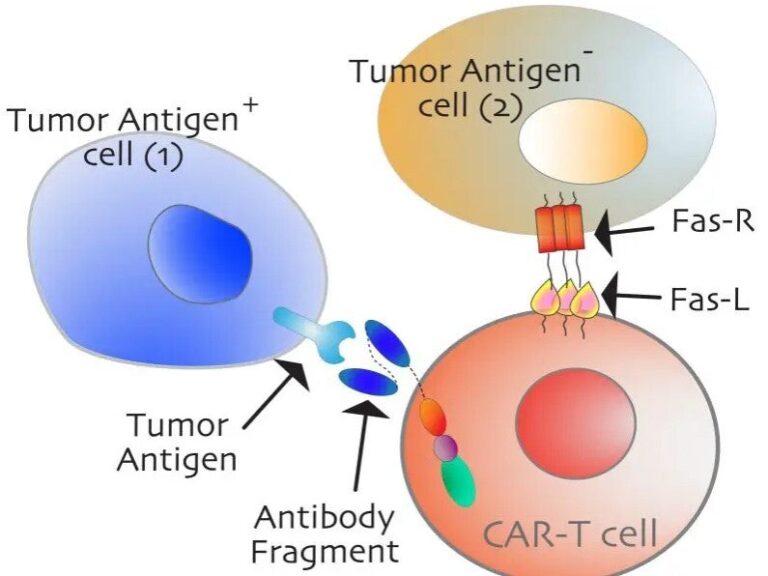
«Αυτοί συχνά ονομάζονται ψυχροί όγκοι επειδή τα κύτταρα του ανοσοποιητικού συστήματος απλά δεν μπορούν να διεισδύσουν στα μικροπεριβάλλοντα για να παρέχουν θεραπευτικό αποτέλεσμα», δήλωσε ο Tushir-Singh. «Δεν έχει σημασία πόσο καλά κατασκευάζουμε τον ανοσοποιητικό υποδοχέα που ενεργοποιεί τα αντισώματα και τα Τ κύτταρα εάν δεν μπορούν να πλησιάσουν τα καρκινικά κύτταρα. Ως εκ τούτου, πρέπει να δημιουργήσουμε χώρους ώστε τα Τ κύτταρα να μπορούν να διεισδύσουν»
Οι «υποδοχείς θανάτου» κάνουν ακριβώς αυτό που υποδηλώνει το όνομά τους – όταν στοχεύουν, προκαλούν προγραμματισμένο κυτταρικό θάνατο των καρκινικών κυττάρων. Προσφέρουν μια πιθανή λύση που θα μπορούσε ταυτόχρονα να σκοτώσει τα καρκινικά κύτταρα και να ανοίξει το δρόμο για πιο αποτελεσματικές ανοσοθεραπείες και θεραπεία με CAR Τ-κύτταρα.
Η ανάπτυξη φαρμάκων που ενισχύουν τη δραστηριότητα των υποδοχέων θανάτου θα μπορούσε να αποτελέσει σημαντικό όπλο κατά των όγκων. Ωστόσο, αν και οι φαρμακευτικές εταιρείες είχαν κάποια επιτυχία στοχεύοντας τον υποδοχέα θανάτου-5, κανένας αγωνιστής Fas δεν έχει φτάσει σε κλινικές δοκιμές. Αυτά τα ευρήματα θα μπορούσαν ενδεχομένως να το αλλάξουν αυτό
Ο σωστός στόχος
Ενώ ο Fas παίζει ουσιαστικό ρόλο στη ρύθμιση των κυττάρων του ανοσοποιητικού συστήματος, ο Tushir-Singh και οι συνεργάτες του γνώριζαν ότι θα μπορούσαν να στοχεύσουν τα καρκινικά κύτταρα επιλεκτικά εάν έβρισκαν τον σωστό επίτοπο.
Έχοντας εντοπίσει αυτόν τον συγκεκριμένο επίτοπο, αυτός και άλλοι ερευνητές μπορούν τώρα να σχεδιάσουν μια νέα κατηγορία αντισωμάτων για να συνδεθούν επιλεκτικά και να ενεργοποιήσουν το Fas για να καταστρέψουν δυνητικά τα καρκινικά κύτταρα ειδικά.
Άλλες έρευνες σε ζωικά μοντέλα και κλινικές δοκιμές σε ανθρώπους έχουν δείξει ότι η σηματοδότηση Fas είναι θεμελιώδης για την επιτυχία της CAR T, ιδιαίτερα σε όγκους που είναι γενετικά ετερογενείς. Οι γενετικά ετερογενείς όγκοι έχουν ένα μείγμα διαφορετικών τύπων κυττάρων, τα οποία μπορούν να ανταποκριθούν διαφορετικά στη θεραπεία.
Ένας αγωνιστής Fas θα μπορούσε να δημιουργήσει ένα φαινόμενο παρευρισκομένων CAR-T, στο οποίο η θεραπεία καταστρέφει τα καρκινικά κύτταρα που στερούνται το μόριο που έχει σχεδιαστεί να χτυπήσει το αντίσωμα στόχευσης όγκου. Με άλλα λόγια, η ενεργοποίηση του Fas μπορεί να καταστρέψει τα καρκινικά κύτταρα και να βελτιώσει την αποτελεσματικότητα του CAR T, μια πιθανή γροθιά κατά των όγκων.
Στην πραγματικότητα, η μελέτη έδειξε ότι οι όγκοι με μεταλλαγμένη έκδοση του επιτόπου των υποδοχέων Fas δεν θα ανταποκριθούν καθόλου στο CAR T. Αυτό το εύρημα θα μπορούσε να οδηγήσει σε νέες δοκιμές για να προσδιοριστεί ποιοι ασθενείς θα ωφεληθούν περισσότερο από την ανοσοθεραπεία CAR T-κυττάρων.
«Θα πρέπει να γνωρίζουμε την κατάσταση Fas ενός ασθενούς – ιδιαίτερα τις μεταλλάξεις γύρω από τον ανακαλυφθέντα επίτοπο – πριν καν εξετάσουμε το ενδεχόμενο να του δώσουμε CAR T», δήλωσε ο Tushir-Singh. «Αυτός είναι ένας οριστικός δείκτης για την αποτελεσματικότητα της θεραπείας με CAR T από παρευρισκόμενους. Αλλά το πιο σημαντικό, αυτό θέτει τις βάσεις για την ανάπτυξη αντισωμάτων που ενεργοποιούν το Fas, σκοτώνουν επιλεκτικά τα καρκινικά κύτταρα και ενδεχομένως υποστηρίζουν τη θεραπεία με CAR T-κύτταρα σε συμπαγείς όγκους».
Η μελέτη χρηματοδοτήθηκε από το Εθνικό Ινστιτούτο Καρκίνου και το Υπουργείο Άμυνας των ΗΠΑ.
Πηγή: Scitechdaily